


返回列表發(fā)布時間:2024/6/17 16:09:19
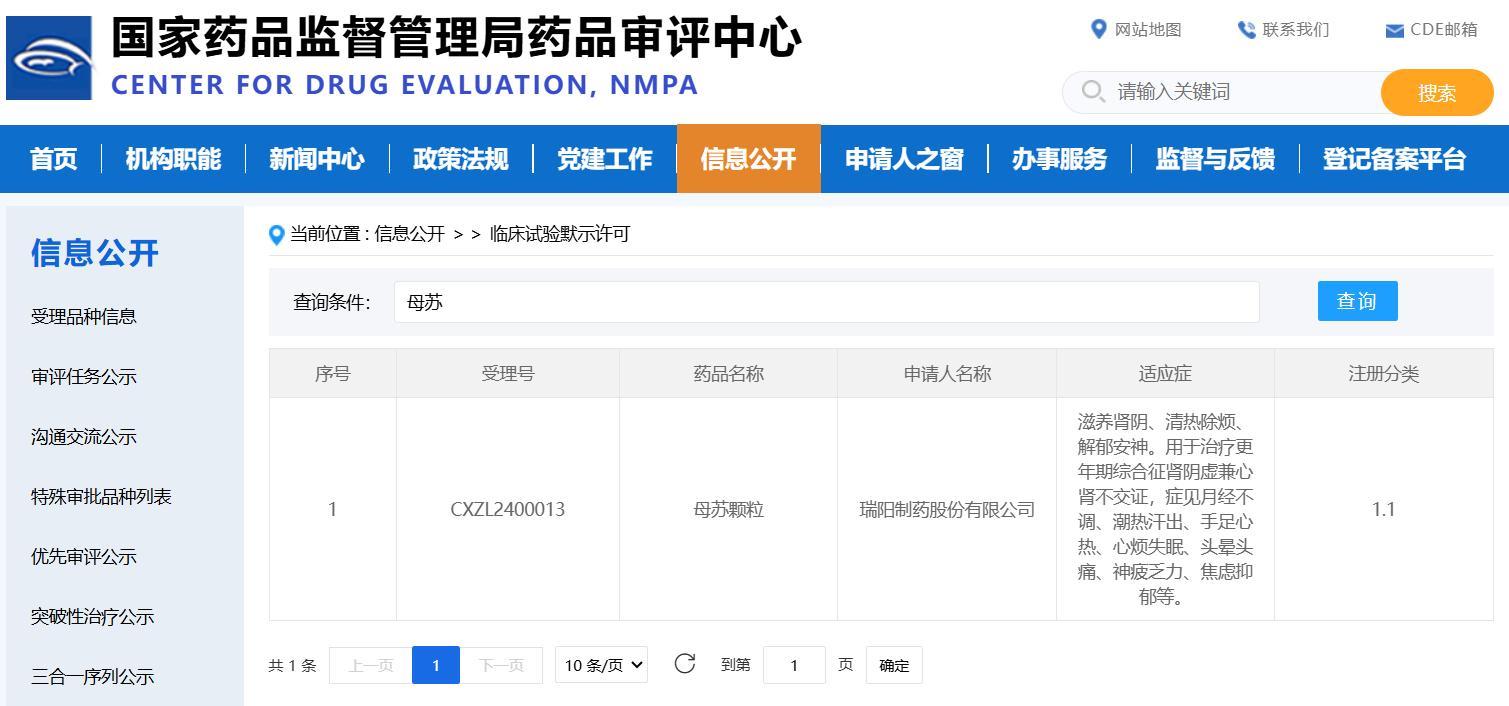
近日,在省藥科院的協(xié)助下,國內(nèi)某藥企開發(fā)的母蘇顆粒獲批臨床試驗,該產(chǎn)品注冊分類為中藥新藥1.1類。
省藥科院新藥評價中心作為該藥企的合作伙伴,在遵循NMPA指導(dǎo)原則的基礎(chǔ)上,根據(jù)項目需求制訂了嚴謹縝密的設(shè)計方案,完成臨床前安全性評價研究,助力其獲得國家藥品監(jiān)督管理局的藥物臨床試驗?zāi)J許可。
省藥科院新藥評價中心作為山東省領(lǐng)先的藥物非臨床評價公共服務(wù)平臺,具有近20年GLP條件下藥物安全性評價經(jīng)驗和30余年新藥藥理研究經(jīng)驗。新藥評價中心先后通過國家藥監(jiān)局GLP認證、國際AAALAC認證和CNAS化學(xué)品GLP認證,是目前山東省規(guī)模最大、項目最全、開展GLP時間最早,是山東省唯一一家通過國際AAALAC認證的藥物非臨床評價研究機構(gòu)。新藥評價中心提供個性化方案設(shè)計,以及包括新藥篩選、藥效學(xué)、藥代動力學(xué)及安全性評價的“一站式”臨床前評價研究技術(shù)服務(wù)。
(撰稿:李曉亮)

魯商生活小程序

魯商集團公眾號

魯商集團視頻號

魯商集團抖音號

魯商集團快手號

魯商集團新浪微博
 魯公網(wǎng)安備37010202002320號 聯(lián)絡(luò)我們 | 隱私政策 | 網(wǎng)站地圖
魯公網(wǎng)安備37010202002320號 聯(lián)絡(luò)我們 | 隱私政策 | 網(wǎng)站地圖